https://latamnews.lat/20210312/brasil-aprueba-el-uso-del-medicamento-remdesivir-para-pacientes-con-covid-19-1109885052.html
Brasil aprueba el uso del medicamento Remdesivir para pacientes con COVID-19
Brasil aprueba el uso del medicamento Remdesivir para pacientes con COVID-19
Sputnik Mundo
(Amplía a partir del cuarto párrafo)
Río de Janeiro (Brasil), 12 mar (Sputnik).-La Agencia Nacional de Vigilancia Sanitaria de Brasil (Anvisa) aprobó este
2021-03-12T14:45+0000
2021-03-12T14:45+0000
2021-10-07T11:36+0000
américa latina
brasil
covid-19
vacunación
https://cdn.img.latamnews.lat/img/07e4/0a/10/1093151304_0:75:3072:1803_1920x0_80_0_0_037cb77cf6491b1ff94c842bc501c3c8.jpg
En rueda de prensa, el gerente general de Medicamentos y Productos Biológicos de esta agencia estatal explicó que el registro del Remdesivir es "fruto de la eficacia, seguridad y calidad presentadas".Los representantes de la Anvisa explicaron que la empresa productora de este medicamento presentó una petición de registro el pasado 6 de agosto, y que desde entonces se estaba estudiando la viabilidad de la aprobación.El medicamento ya se usa en calidad de emergencia en EEUU desde noviembre, a pesar de que la Organización Mundial de la Salud (OMS) anunció poco después que el medicamento antiviral no evita muertes ni el agravamiento de la enfermedad.La Anvisa también anunció este 12 de marzo la aprobación del uso definitivo de la vacuna contra el COVID-19 del laboratorio AstraZeneca y la Universidad de Oxford, que hasta ahora se está aplicando en Brasil en clave de emergencia.El registro definitivo dará más autonomía y mayor acceso a la vacuna, ya que hasta ahora sólo podía usarse en los grupos de población prioritarios y más vulnerables a la enfermedad.Hasta ahora, la única vacuna con registro definitivo aprobado en Brasil era la del laboratorio Pfizer, a pesar de que no se está usando en el país porque el Gobierno aún no cerró ningún acuerdo de compra con el fabricante.
https://latamnews.lat/20200629/la-terapia-para-el-covid-19-con-remdesivir-costara-mas-de-2000-euros-por-paciente-1091914655.html
brasil
Sputnik Mundo
contacto@sputniknews.com
+74956456601
MIA „Rosiya Segodnya“
2021
Sputnik Mundo
contacto@sputniknews.com
+74956456601
MIA „Rosiya Segodnya“
Noticias
es_ES
Sputnik Mundo
contacto@sputniknews.com
+74956456601
MIA „Rosiya Segodnya“
Sputnik Mundo
contacto@sputniknews.com
+74956456601
MIA „Rosiya Segodnya“
brasil, covid-19, vacunación
brasil, covid-19, vacunación
Brasil aprueba el uso del medicamento Remdesivir para pacientes con COVID-19
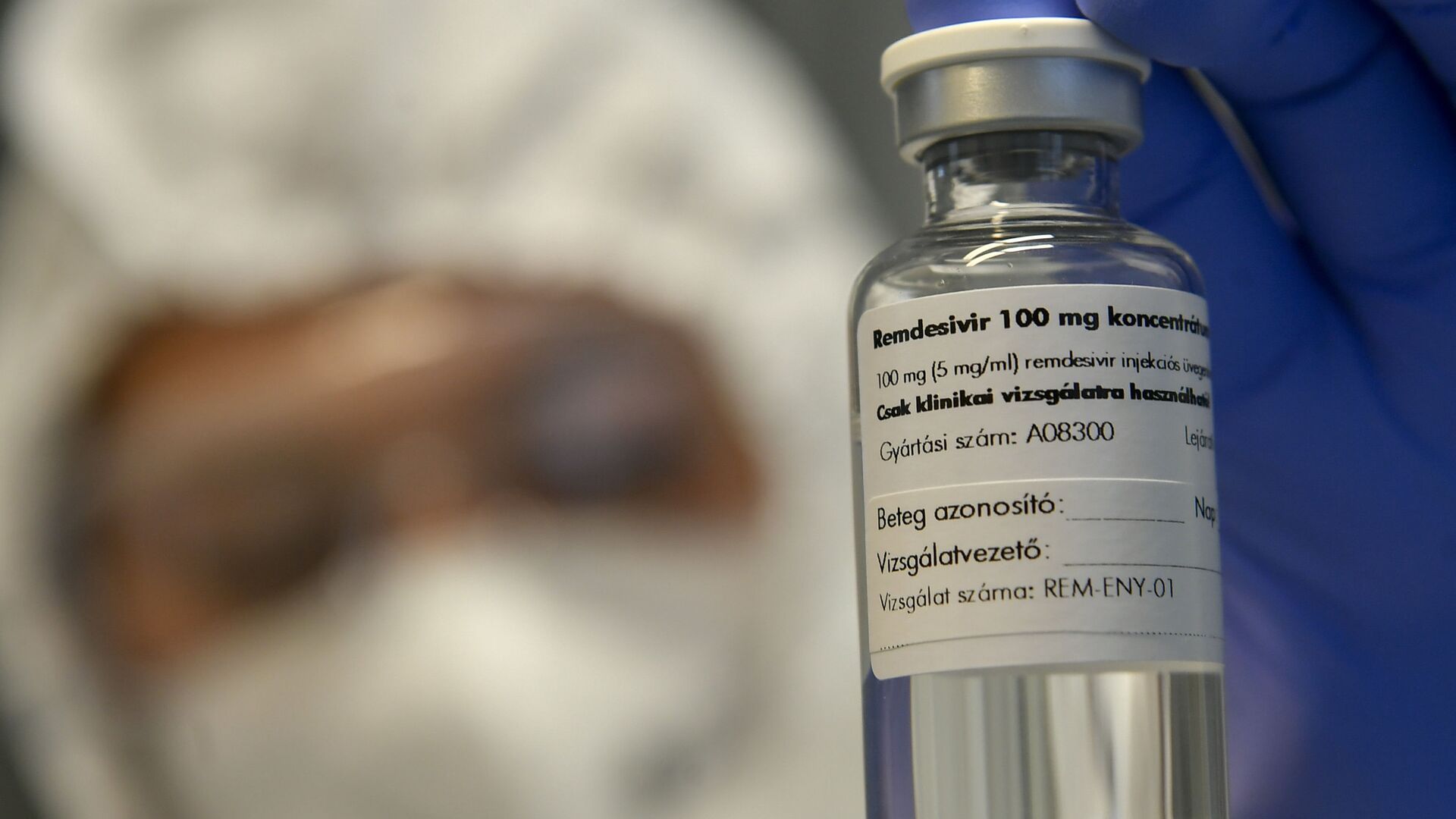
14:45 GMT 12.03.2021 (actualizado: 11:36 GMT 07.10.2021) RÍO DE JANEIRO (Sputnik) — La Agencia Nacional de Vigilancia Sanitaria de Brasil (Anvisa) aprobó el uso del medicamento Remdesivir para pacientes hospitalizados con COVID-19.
En rueda de prensa, el gerente general de Medicamentos y Productos Biológicos de esta agencia estatal explicó que el registro del Remdesivir es "fruto de la eficacia, seguridad y calidad presentadas".
Los representantes de la Anvisa explicaron que la empresa productora de este medicamento presentó una petición de registro el pasado 6 de agosto, y que desde entonces se estaba estudiando la viabilidad de la aprobación.
29 de junio 2020, 19:33 GMT
El medicamento ya
se usa en calidad de emergencia en EEUU desde noviembre, a pesar de que la Organización Mundial de la Salud (OMS) anunció poco después que el medicamento antiviral no evita muertes ni el agravamiento de la enfermedad.
La Anvisa también anunció este 12 de marzo
la aprobación del uso definitivo de la vacuna contra el COVID-19 del laboratorio AstraZeneca y la Universidad de Oxford, que hasta ahora se está aplicando en Brasil en clave de emergencia.
El registro definitivo dará más autonomía y mayor acceso a la vacuna, ya que hasta ahora sólo podía usarse en los grupos de población prioritarios y más vulnerables a la enfermedad.
Hasta ahora, la única vacuna con registro definitivo aprobado en Brasil era la del laboratorio Pfizer, a pesar de que no se está usando en el país porque el Gobierno aún no cerró ningún acuerdo de compra con el fabricante.